
※承認された効能又は効果は次の通りです。
〇アレルギー性鼻炎
〇蕁麻疹
〇皮膚疾患(湿疹・皮膚炎、皮膚そう痒症)に伴うそう痒

2. 禁忌(次の患者には投与しないこと)
2.1 本剤の成分に対し過敏症の既往歴のある患者
〇アレルギー性鼻炎
〇蕁麻疹
〇皮膚疾患(湿疹・皮膚炎、皮膚そう痒症)に伴うそう痒
通常、成人にはビラスチンとして1回20mgを1日1回空腹時に経口投与
する。

1) スギ花粉曝露室を用いたTAC-202の前期臨床第Ⅱ相試験,社内資料, 研究報告書No.640(2016)<承認時評価資料>
2) Hashiguchi K, et al.: Allergol Int.,66,123(2017)
本研究は大鵬薬品工業株式会社の資金により行われた。
本論文の著者には大鵬薬品工業株式会社の社員と大鵬薬品工業株式会社から報酬を受領している者が含まれる。
3) 通年性アレルギー性鼻炎患者を対象としたTAC-202の臨床第Ⅲ相試験,社内資料, 研究報告書No.641(2016)<承認時評価資料>
4) Okubo K,et al.: Allergol Int.,66,97(2017)
本研究は大鵬薬品工業株式会社の資金により行われた。
本論文の著者には大鵬薬品工業株式会社の社員と大鵬薬品工業株式会社から報酬を受領している者が含まれる。
5) 通年性及び季節性アレルギー性鼻炎患者を対象としたTAC-202の臨床第Ⅲ相長期投与試験,社内資料, 研究報告書No.642(2016)<承認時評価資料>
6) Okubo K, et al.: Auris Nasus Larynx, 44, 294(2017)
本研究は大鵬薬品工業株式会社の資金により行われた。
本論文の著者には大鵬薬品工業株式会社の社員と大鵬薬品工業株式会社から報酬を受領している者が含まれる。
7) 慢性蕁麻疹患者を対象としたTAC-202の臨床第Ⅱ/Ⅲ相試験,社内資料, 研究報告書No.643(2016)<承認時評価資料>
8) Hide M, et al.: Allergol Int., 66, 317(2017)
本研究は大鵬薬品工業株式会社の資金により行われた。
本論文の著者には大鵬薬品工業株式会社の社員と大鵬薬品工業株式会社から報酬を受領している者が含まれる。
9) 慢性蕁麻疹及び皮膚疾患に伴うそう痒患者を対象としたTAC-202の臨床第Ⅲ相長期投与試験,社内資料, 研究報告書No.644(2016)<承認時評価資料>
10) Yagami A, et al.: J Dermatol., 44, 375(2017)
本研究は大鵬薬品工業株式会社の資金により行われた。
本論文の著者には大鵬薬品工業株式会社の社員と大鵬薬品工業株式会社から報酬を受領している者が含まれる。
11) Mair SJ: A phase I study to investigate the absorption, metabolism and excretion of [14C]-bilastine following oral administration to healthy volunteers,社内資料, 研究報告書No.595(2016)
12) Johanning K: In Vitro Assessment of Human Liver Cytochrome P450 Inhibition Potential of Bilastine,社内資料,研究報告書No.586(2016)
13) Johanning K: in vitro Assessment of Cytochrome P450 Induction Potential of Bilastine in Primary Human Hepatocytes,社内資料, 研究報告書No.587(2016)
14) 健康成人を対象としたTAC-202 錠とTAC-202OD 錠の生物学的同等性試験,社内資料, 研究報告書No.RR21CD001(2021)<承認時評価資料>
※1 承認された用法及び用量は次の通りです。
通常、成人にはビラスチンとして1回20mgを1日1回空腹時に経口投与する。
※2 承認された効能又は効果は次の通りです。
〇アレルギー性鼻炎
〇蕁麻疹
〇皮膚疾患(湿疹・皮膚炎、皮膚そう痒症)に伴うそう痒

本試験は、用量反応性の検討を目的の1つとして実施されました。
そのため、紹介する結果には一部承認用量と異なる成績が含まれています。
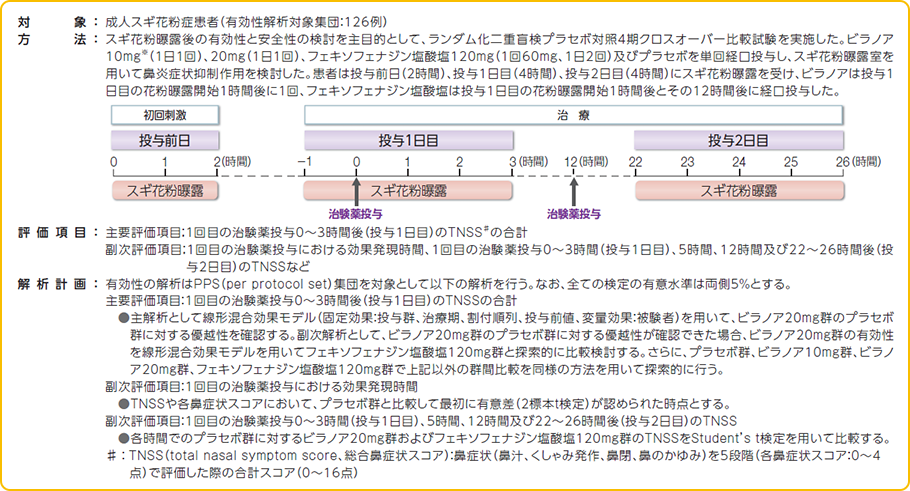

副作用(臨床検査値の異常変動を含む)はビラノア10mg群で134例中1例(0.7%)、フェキソフェナジン塩酸塩120mg群で135例中3例(2.2%)に認められた。なお、ビラノア20mg群、プラセボ群に副作用の発現は認められなかった。発現した副作用は、ビラノア10mg群で口渇1例(0.7%)、フェキソフェナジン塩酸塩120mg群で肝機能検査異常、頭痛、傾眠各1例(0.7%)であった。本試験において重篤な副作用及び投与中止にいたる副作用の発現、死亡例は認められなかった。
1) スギ花粉曝露室を用いたTAC-202の前期臨床第Ⅱ相試験,社内資料,研究報告書No.640(2016)<承認時評価資料>
2) Hashiguchi K, et al.: Allergol Int.,66,123(2017)
本研究は大鵬薬品工業株式会社の資金により行われた。
本論文の著者には大鵬薬品工業株式会社の社員と大鵬薬品工業株式会社から報酬を受領している者が含まれる。
※承認された用法及び用量は次の通りです
通常、成人にはビラスチンとして1回20mgを1日1回空腹時に経口投与する。

![TNSSの期間平均変化量[ベースライン(投与の4~1日前の計4日間の平均TNSS)に対する投与10~13日目の計4日間の平均TNSSの変化量] 主要評価項目 TNSSの経日推移(投与1~13日目) 副次評価項目](img/allergic-rhinitis_002_02.png)
副作用(臨床検査値の異常変動を含む)はビラノア20mg群で255例中5例(2.0%)、プラセボ群で255例中2例(0.8%)、フェキソフェナジン塩酸塩120mg群で254例中5例(2.0%)に認められた。発現した副作用は、ビラノア20mg群で傾眠2例(0.8%)、下痢、鼻乾燥、円形脱毛症各1例(0.4%)、プラセボ群で腹痛、白血球数増加各1例(0.4%)、フェキソフェナジン塩酸塩120mg群で口内炎、血中アルカリホスファターゼ増加、浮動性めまい、頭痛、傾眠各1例(0.4%)であった。本試験において重篤な副作用及び投与中止にいたる副作用の発現、死亡例は認められなかった。
3) 通年性アレルギー性鼻炎患者を対象としたTAC-202の臨床第Ⅲ相試験, 社内資料, 研究報告書No.641(2016)<承認時評価資料>
4) Okubo K, et al.: Allergol Int.,66,97(2017)
本研究は大鵬薬品工業株式会社の資金により行われた。
本論文の著者には大鵬薬品工業株式会社の社員と大鵬薬品工業株式会社から報酬を受領している者が含まれる。

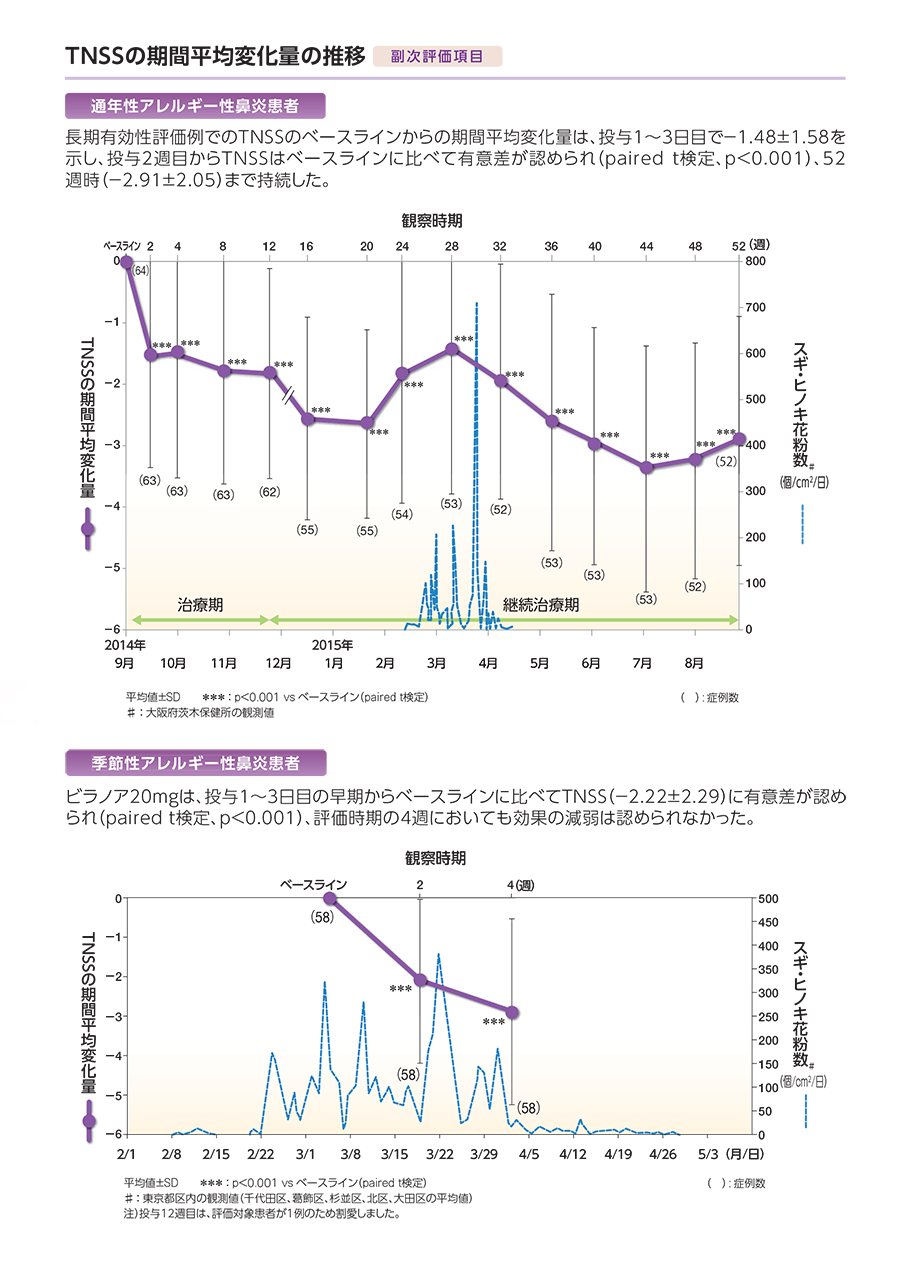
通年性アレルギー性鼻炎患者における副作用(臨床検査値の異常変動を含む)は64例中4例(6.3%)に認められた。発現した副作用は、口渇2例(3.1%)、上腹部痛、頭痛各1例(1.6%)であった。なお、季節性アレルギー性鼻炎患者58例に副作用は認められなかった。本試験において重篤な副作用及び投与中止にいたる副作用の発現、死亡例は認められなかった。52週間の長期投与で発現率が高くなる副作用や遅発性の副作用は認められなかった。
5) 通年性及び季節性アレルギー性鼻炎患者を対象としたTAC-202の臨床第Ⅲ相長期投与試験, 社内資料, 研究報告書No.642(2016)<承認時評価資料>
6) Okubo K, et al.: Auris Nasus Larynx, 44, 294(2017)
本研究は大鵬薬品工業株式会社の資金により行われた。
本論文の著者には大鵬薬品工業株式会社の社員と大鵬薬品工業株式会社から報酬を受領している者が含まれる。

※ 承認された効能又は効果は次の通りです。
〇アレルギー性鼻炎
〇蕁麻疹
〇皮膚疾患(湿疹・皮膚炎、皮膚そう痒症)に伴うそう痒
本試験は、用量反応性の検討を目的の1つとして実施されました。
そのため、紹介する結果には一部承認用量と異なる成績が含まれています。

![TSSの期間平均変化量[ベースライン(投与の4~1日前の計4日間の平均スコア)に対する投与8~14日目の計7日間の平均スコアの変化量] 副次評価項目 TSSの変化量の経日推移 副次評価項目](img/pruritus_001_02.png)
副作用(臨床検査値の異常変動を含む)はビラノア20mg群で101例中2例(2.0%)、ビラノア10mg群で100例中6例(6.0%)、プラセボ群で103例中3例(2.9%)に認められた。発現した副作用は、ビラノア20mg群で血中ビリルビン増加、頭痛各1例(1.0%)、ビラノア10mg群で傾眠2例(2.0%)、腹部不快感、便秘、悪心、倦怠感、口渇各1例(1.0%)、プラセボ群で口内炎、歯痛、胸痛、口渇、傾眠各1例(1.0%)であった。本試験において重篤な副作用及び投与中止にいたる副作用の発現、死亡例は認められなかった。
7) 慢性蕁麻疹患者を対象としたTAC-202の臨床第Ⅱ/Ⅲ相試験, 社内資料, 研究報告書No.643(2016)<承認時評価資料>
8) Hide M, et al.: Allergol Int., 66, 317(2017)
本研究は大鵬薬品工業株式会社の資金により行われた。
本論文の著者には大鵬薬品工業株式会社の社員と大鵬薬品工業株式会社から報酬を受領している者が含まれる。
※承認された用法及び用量は次の通りです。
通常、成人にはビラスチンとして1回20mgを1日1回空腹時に経口投与する。

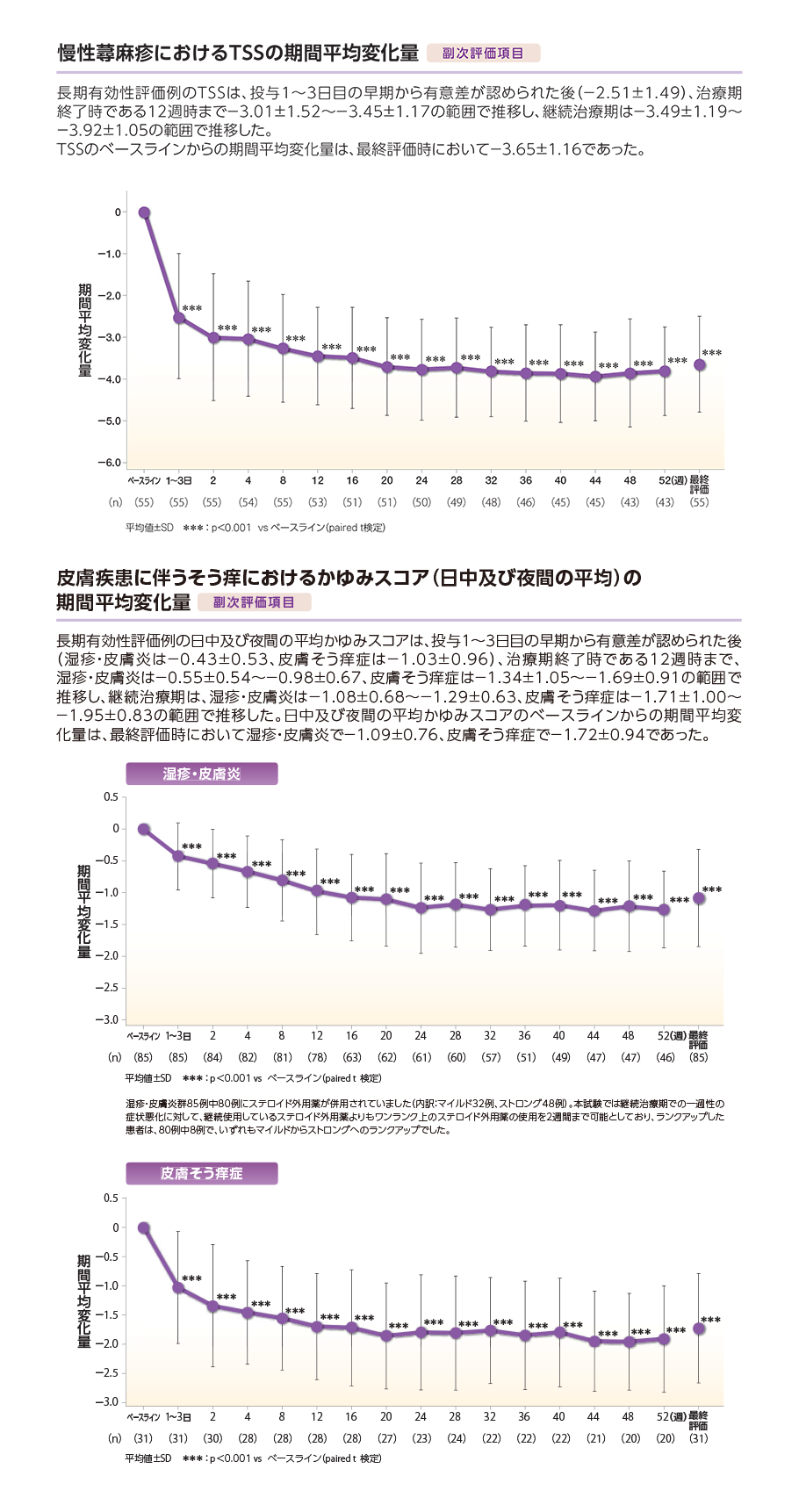
副作用(臨床検査値の異常変動を含む)は197例中5例(2.5%)に認められた。発現した副作用は、傾眠2例(1.0%)、アスパラギン酸アミノトランスフェラーゼ増加、γ-グルタミルトランスフェラーゼ増加、夜間頻尿各1例(0.5%)であった。
本試験において重篤な副作用及び投与中止にいたる副作用の発現、死亡例は認められなかった。
52週間の長期投与で発現率が高くなる副作用や遅発性の副作用は認められなかった。
9) 慢性蕁麻疹及び皮膚疾患に伴うそう痒患者を対象としたTAC-202の臨床第Ⅲ相長期投与試験,社内資料,研究報告書No.644(2016)<承認時評価資料>
10) Yagami A, et al.: J Dermatol., 44, 375(2017)
本研究は大鵬薬品工業株式会社の資金により行われた。
本論文の著者には大鵬薬品工業株式会社の社員と大鵬薬品工業株式会社から報酬を受領している者が含まれる。
※ 承認された効能又は効果は次の通りです。
〇アレルギー性鼻炎
〇蕁麻疹
〇皮膚疾患(湿疹・皮膚炎、皮膚そう痒症)に伴うそう痒



